Loi de Henry :la dissolution des gaz
On abordera dans ce cours la dissolution des gaz dans les liquides.
Le but du cours : comprendre la nécessité et la base théorique des tables de décompression pour éviter les accidents de décompression ou biophysiques (voir cours suivant) c'est à dire ceux dus à une mauvaise dessaturation du gaz azote dissous dans l'organisme lors d'une plongée.
La matière existe sous 3 états : solide, liquide, gazeux. C'est la notion de phase. Le passage d'une phase à l'autre dépend de différents facteurs comme la composition chimique des liquides ou gaz, la température la pression, l'agitation, la surface d'échange entre les 2 phases, le renouvellement d'une des phases. On peut donner quelques exemples :
- pour la composition chimique : on peut dissoudre un nombre important de corps différents dans l'eau : alcool, sucre, sel, air etc. . Pour chacun de ces corps, il y a une dissolution différente propre à sa composition chimique.
- pour la température : la casserole d'eau que l'on fait chauffer et dont la paroi se recouvre de bulles avant même l'ébullition prouvant par-là même la présence d'air dans l'eau.
- pour la pression et l'agitation : la bouteille de champagne est sans présence de bulles tant qu'elle est fermée, mais libère son gaz carbonique dès qu'on la sabre ou par un choc sur le verre.
II) La loi de Henry
à une température donnée, à l'équilibre (saturation) un liquide soumis à une pression partielle P de gaz sur ce liquide alors :
![]()
ou
P : Pression partielle du gaz exercée sur le liquide
Te : Pression exercée par le gaz ou Tension du gaz dans le liquide
K : constante de Henry (à température constante et à la saturation )
C : Concentration du gaz dans le liquide
Pabs : Pression absolue (pour rappel la loi de Dalton P=Pabs*C)
En français :
A une température donnée et à la saturation, la quantité de gaz dissous dans un liquide est proportionnelle à la pression exercée par ce gaz dans le liquide.
appliqué à la plongée :
A une température donnée et au bout d'un certain temps, la quantité d'azote* dissous dans le corps augmente proportionnellement avec la profondeur.
(* Remarque : on ne s'intéressera qu'à l'Azote car l'oxygène est transformé par l'organisme (métabolisé))
III) Etats possibles d'un gaz par rapport à un liquide
Soit P la pression externe s'exerçant sur le liquide.
Soit Te la tension du gaz dans ce liquide.
On dira que :
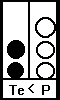
le gaz est en état de sous-saturation si Te < P
en français : le gaz entre dans le liquide et ne ressort pas
Appliqué à la plongée : le plongeur qui descend au début de sa plongée.
le gaz est en état de saturation si Te = P
En Français : le gaz entre et ressort du liquide en part égale
Appliqué à la plongée : le plongeur sur le bateau avant sa plongée.
Le plongeur qui remonte après une plongée suffisamment longue.
le gaz est en état de sur-saturation sit Te > P
En français : la quantité de gaz qui entre est inférieure à celle qui sort
Appliqué à la plongée : le plongeur qui remonte pour effectuer son palier
le gaz est en état de saturation critique si Te > Sc * Pabs
En français : la tension du gaz est telle que celui-ci ne peut plus rester dissous dans le liquide. Des bulles apparaissent, c'est la germination
Appliqué à la plongée : le plongeur qui ne respecte pas les tables de décompression en remontant trop vite va subir une dessaturation critique (germination de bulles d'azote) qui va s'amplifier sous l'action de la loi de Mariotte : c'est l'accident de décompression ou maladie de décompression.
On remarquera que le passage d'un état à l'autre ne se fait pas instantanément. La saturation d'un gaz dans un tissu ( ou compartiment ) met un certain temps qui dépend du type de tissu. On appellera période Ts d'un compartiment le temps que met ce compartiment soumis à une pression P à se laisser pénétrer par un gaz jusqu'à obtenir une tension égale à Te=P/2. Ces notions de tissus ou compartiments, de période associée, de saturation critique et de vitesse de remontée sont à la base de l'établissement des tables de plongées Gers 65 puis MN90. Dans le modèle MN90 on a choisi 12 tissus ou compartiments dont les coefficients de saturation critique sont les suivants.
| Période(mn) |
5 |
7 |
10 |
15 |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
120 |
|
Sc |
2,72 |
2,54 |
2,38 |
2,2 |
2,04 |
1,82 |
1,68 |
1,61 |
1,58 |
1,56 |
1,55 |
1,54 |
On aura toujours la relation suivante juste avant la dessaturation critique : Sc = Tc/Pabs
C'est à dire que le coefficient de sursaturation critique est le rapport admissible maximum entre la tension que peut supporter un compartiment avant la germination et la pression ambiante (Pabs).
Exemple : Un plongeur va à 40 m.
Quel est la tension maximale d'azote admissible ? 40 m Pabs = 5 bars => Dalton P=5*0.8= 4 bars
D'où la tension max. A la saturation Te=P = 4 bars.
En supposant qu'il y reste suffisamment pour que son compartiment 20 mn atteigne une tension T = 3,2 bars d'azote.
En remontant à vitesse normale, à quelle profondeur risque t il un ADD ?
Pabs = Tc/Sc=3,2/2,04 = 1,57 bars soit 6m
Le dessin suivant illustre les différentes phases de dissolution de l'azote lors d'une plongée
SURFACE
_____________________________________________Remontée_anormale Remontée_Correcte
Germination Légère SUR-SATURATION
Accident de décompression
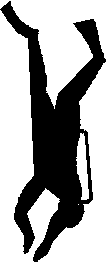
 SATURATION
Paliers
SATURATION
Paliers



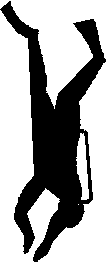
 SOUS-SATURATION
SUR-SATURATION
SOUS-SATURATION
SUR-SATURATION


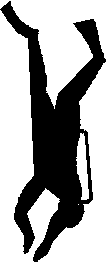
 SOUS-SATURATION
SOUS-SATURATION



 SOUS-SATURATION
SATURATION
SOUS-SATURATION
SATURATION
________________________________________________________________________________________________________ FOND
IV) Ce qu'il faut retenir
- Un gaz dans un liquide possède 4 états possibles :
-sous-saturation
-saturation
-sur-saturation
-saturation critique ou germination
- Pour éviter les accidents de décompression, il faut non seulement respecter les tables de décompression et la vitesse de remontée, mais aussi faire attention aux facteurs aggravants
suivants : Température, fatigue et essoufflement, stress, alcool, ne pas souffler lors de la remontée.
V Exercices
Exercice 1 : Quelle est la tension d'azote d'un plongeur en surface qui n'a pas encore plongé ?
Exercice 2 : Quelle est la tension d'azote d'un plongeur à 30 m supposé à la
saturation ? On admet que le coefficient de saturation critique de ce plongeur est 2. Il remonte en catastrophe. A partir de quelle profondeur va - t - il entrer en phase de germination ?
Exercice 3 : On suppose qu'un plongeur est resté à 40 m jusqu'à saturation. Sa période est de 20 mn et son coefficient de saturation critique est de 2. Quelle durée de palier devra - t - il faire avant de remontée ?
VI Réponses aux exercices
Exercice 1 : Quelle est la tension d'azote d'un plongeur en surface qui n'a pas encore plongé ?
Réponse 1 : T = Pression partielle de N2 (azote) = 1bar * 80/100 = 0,8 bars
Exercice 2 : Quelle est la tension d'azote d'un plongeur à 30 m supposé à la
saturation ? On admet que le coefficient de saturation critique de ce plongeur est 2. Il remonte en catastrophe. A partir de quelle profondeur va - t - il entrer en phase de germination ?
Réponse 2 : T = 0,8 * (30/10+1) = 3,2 bars
Il y a saturation critique pour la pression P suivante : P = 3,2/2 = 1,6 bars soit une profondeur de 6 m.
Exercice 3 : On suppose qu'un plongeur est resté à 40 m jusqu'à saturation. Sa période est de 20 mn et son coefficient de saturation critique est de 2. Quelle durée de palier devra - t - il faire avant de remontée ?
Réponse 3 : sa tension d'azote à 40 m est T = 0,8 * (40/10 + 1) = 4 bars
La pression critique vaut P = T/Sc=4/2=2 bar. Donc si ce plongeur veut remonter, il doit attendre que sa tension d'azote passe de 4 bars à 2 bars soit un rapport deux. Il s'agit donc d'une période Ts = 20 mn. Le palier devra être de 20 mn à 10 m.
Loi de Dalton et loi de Henry
1) Rappels
-pression et loi de Mariotte PV = cste (Très important : la constante est caractéristique de la quantité d’air du volume fermé)
2) Constitution de l’air :
-on respire un mélange de gaz
-composition simplifiée 80% N2 20% O2
-composition complète 79% N2 , 20.9% O2
0.03% CO2 , 0.07% gaz rares
3) Notion de pression partielle
on appelle pression partielle d’un gaz dans un mélange dans un volume fermé la pression qui aurait s’il occupait seul le volume .
Exemple : 2 volumes V avec 02 et N2 à la même pression P on réuni les 2 volumes
les pressions partielles des gaz sont 0.5 bar pour N2 et 0.5 bar pour O2 .
4) La loi de DALTON
La pression partielle d’un gaz dans un mélange est proportionnelle à la pression absolue exercée sur ce mélange et à la concentration de ce gaz .
Ppartielle = Pabsolue * Concentration
conséquence : la somme des pressions partielles est égale à la pression totale ou absolue .
Exemple : à 40 m quelle est la pression partielle de N2 sur l ’air respiré par un plongeur ? à 30 m pression partielle de O2 sur l ’air respiré par un plongeur ?
5) Dissolution des gaz dans les liquides
- bouteille de limonade
- l’eau qui boue
- facteurs qui influence la dissolution : nature gaz , nature du milieu , pression , température , temps , chocs et travail physique , surface d’échange .
6) Notion de Tension d’un gaz dans un liquide (T) et de gradient de pression
- c’est la pression d’un gaz dans un liquide soumis à une pression absolue P externe .
- le gradient de pression c’est la différence P-T .
7) Notion de Saturation , sous saturation , sursaturation
- si P>T sous saturation
- si P=T saturation
- si P<T sur saturation
8) Loi de Henry
- A la saturation et à température constante , la pression d’un gaz dans un liquide est proportionnelle à sa concentration .
Tension = K * Concentration
9) Sursaturation critique et notion de tissu et de période
- quand T>>P , le gaz contenu dans le liquide ne peut plus rester dans le liquide => formation de bulles . Le rapport S=T/P est appelé coefficient de sur-saturation .Dans l’organisme la formation de bulles dépend du type de milieu et des échanges gazeux , c’est la notion de tissu ou compartiment .Chaque compartiment aura sont coefficient de sur saturation critique Sc (coeff au voisinage de 2) . Pour atteindre la saturation ou dessaturée il faut un certain temps , il s’agit d’un phénomène dynamique . On appellera la période d’un tissu le temps qu’il met pour atteindre la moitié de sa pression finale de saturation .
10) Conclusion sur la physique appliquée à la Plongée
- tableau de synthèse et feuille d’exercices .
POURQUOI UN PEU DE PHYSIQUE DANS LA PLONGEE
Les lois physiques en jeu |
De quoi elles traitent ? |
Leurs impacts concrets sur la plongée |
|
le théorème d’Archimède la poussée d’Archimède Parch. = 1Kg/litre * Veau Papparent=Préel-Parch |
L’équilibre du plongeur |
- savoir estimer son lestage les conséquences : *éviter l’essoufflement et la noyade * paliers plus faciles * meilleure autonomie -savoir se déplacer dans l’eau et compenser les variations d’équilibre(poumon ballast/stab.) |
|
les pressions et la loi de Mariotte
P*V=cste ou P1*V1 = P2 * V2 |
L’équilibre des gaz dans les milieux fermés |
- compréhension de tous les barotraumatismes - comprendre comment on peut estimer l’autonomie d’air d’un plongeur -comprendre le fonctionnement du matériel de plongée |
|
la loi de Dalton
Ppartiel=Ptotale*Concentration(%) |
les pressions des mélanges de gaz ou pressions partielles |
-savoir ce qu’on respire - comprendre et éviter les accidents biochimiques:
essoufflement , narcose et anoxie |
|
la loi de Henry Tgaz= K *Concentration |
Dissolution des gaz dans les liquides |
comprendre et éviter les accidents de décompression |